ماذا يقصد بـ ترتيب الإلكتروني للعناصر
هو الكيفية التي تتوزع فيها الإلكترونات في مدارات الذرة .
ويحكم توزيع الإلكترونات في مدارات الذرة عدد من القواعد :
قاعدة أوف باو ،
قاعدة هوند ،
قاعدة الاستبعاد لباولي .
قاعدة هوند ،
قاعدة الاستبعاد لباولي .
أولا : قاعدة أوف باو .او مبدأ البناء التصاعدى
تدخل الإلكترونات في مستويات الطاقة الفرعية ذات الطاقة المخفضة أولا ثم تملأ الأعلى منها بعد ذلك .
ملاحظة : طاقة المدار تزداد بزيادة عدد الكم.
عدد الكم الرئيسي والتي غالبا ما تكتب n
وهو يمثل طاقة المدار ومدى بعده عن النواة.
عدد الكم الرئيسي والتي غالبا ما تكتب n
وهو يمثل طاقة المدار ومدى بعده عن النواة.
ويمكن توضيح ترتيب ملء المدارات حسب قاعدة أوف باو من خلال الرسمتين التاليتين
كلاهما صحيحية لكن الإختلاف في التصميم
كلاهما صحيحية لكن الإختلاف في التصميم
الرسمة توضح طريقة التوزيع الإلكتروني حيث نبدء من 1s ثم 2s ثم 2p ثم 3sوهكذا
* حيث
المدار S يستوعب عدد 2 إلكترون
المدار p يستوعب عدد 6 إلكترون
المدار d يستوعب عدد 10 إلكترون
المدار f يستوعب عدد 14 إلكترون
المدار S يستوعب عدد 2 إلكترون
المدار p يستوعب عدد 6 إلكترون
المدار d يستوعب عدد 10 إلكترون
المدار f يستوعب عدد 14 إلكترون
مثال التوزيع الإلكتروني للـعناصر التالية
18Ar: 1s2 2s2 2p6 3s2 3p6
36Kr: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
54Xe: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s24d10 5p6
79Au: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1 4f14 6d10
ملاحظة من خلال ماسبق وفقا لقاعدة أوف باو
نلاحظ أنه يتم ملء المدار 4S قبل المدار 3d
والسبب ان تداخلات المدارات تجعل مدار 3d أعلى في الطاقة من مدار 4S .
والسبب ان تداخلات المدارات تجعل مدار 3d أعلى في الطاقة من مدار 4S .
استثناءات هناك استثناءات لقاعدة أوف باو .
حالات استقرار المدار أن يكون ممتلىء أو نصف ممتلىء أو فارغ
ولهذا نجد بعض الاستثناءات من قاعدة أوف باو ولتوضيح ذلك نأخذ
المثال التالي
المثال التالي
مثال: النحاس له العدد الذري 29
Cu : 1S2 2S2 2P6 3S2 3p6 4S1 3d10
نلاحظ أنه تم ملأ المدار 3d ومن ثم العودة لمدار 4s .
_____________
ثانيا: مبدأ باولي للاستبعاد
ينص هذا المبدأ على أنه لا يمكن أن تتساوى الأعداد الكمية الأربعة لأي إلكترونين في ذرة واحدة !
فعلى سبيل المثال،
لا يمكن لإلكترونين في ذرة واحدة أن يكون لهم ذات أعداد الكم الأربعة؛
فإذا كان n، وℓ، وmℓ متشابهين بين إلكترونين أو أكثر، فإن ms يجب أن يكون مختلفاً
بمعنى أن كل واحد منهم يدور باتجاه معاكس للآخر، وهكذا.
لا يمكن لإلكترونين في ذرة واحدة أن يكون لهم ذات أعداد الكم الأربعة؛
فإذا كان n، وℓ، وmℓ متشابهين بين إلكترونين أو أكثر، فإن ms يجب أن يكون مختلفاً
بمعنى أن كل واحد منهم يدور باتجاه معاكس للآخر، وهكذا.
_________________
قاعدة هوند
تميل الإلكترونات أن تكون منفردة في المدار الذري مالم يكن عددها أكبر من عدد المدارات .
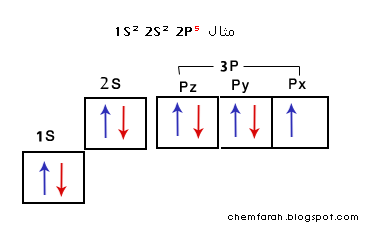
مثال : مدار P يحوي 3 مدارات متساوية في الطاقة هيPx ,Py, Pz كل منهم يستوعب إلكترونين،
فإذا كانت عدد الإلكترونات 3 أو أقل فأنه يتم توزيعها فرادى على المدارات الثلاث
وإذا زاد عن الثلاثة فيتم البدء في دمج الإكترونات.
بعض الامثلة
للوصول إلى التركيب الإلكتروني الصحيح لذرة العنصر يجب مراعاة القواعد الآتية :
1 – عدد الإلكترونات التي يتم وزيعها على المدارات الذرة المتعادلة يساوي العدد الذري للعنصر .
2 – لا يحتوي المدار الواحد أكثر من إلكترونين .
3 – مراعاة قاعدة هوند عند توزيع الإلكترونات على المدارات المستويات الفرعية .
4 – عند توزيع الإلكترونات على المدارات تملأ المدارات بدء من المدار الأقل طاقة فالمدار الأعلى طاقة .






ليست هناك تعليقات:
إرسال تعليق